2024年4月15日,威斯尼斯人615CC棋牌未来技术学院王寒团队在Structure期刊在线发表题为Structural basis for the immune recognition and selectivity of the immune receptor PVRIG for ligand Nectin-2的研究论文,该工作解析了免疫检查点分子PVRIG与其靶细胞配体Nectin-2的复合物结构,阐明了PVRIG参与免疫识别和其配体选择性背后的分子机理,为免疫检查点抑制剂的研发和免疫治疗干预通路的选择提供依据。

以PD-1/PD-L1和CTLA-4/CD28等为代表的免疫检查点分子在维持机体的免疫稳态中发挥着至关重要的作用。近年来,利用免疫检查点的激活或抑制型抗体药物(即免疫检查点抑制剂,如Nivolumab、Atezolizumab等)重塑机体的免疫反应,为肿瘤和免疫相关疾病的治疗带来了新的希望。
在众多的下一代免疫检查点中,一组通过识别相同Nectin/Necl粘附蛋白家族配体参与免疫细胞功能调控的免疫细胞配对受体(Nectin/Necl共受体家族)正引起广泛关注。Nectin/Necl共受体家族主要包括抑制受体TIGIT、PVRIG(CD112R)和激活型受体DNAM-1(CD226)。其中靶向TIGIT的免疫检查点抑制剂已经被广泛研发,在临床的单药和PD-1/PD-L1联合治疗中展现出显著的抗肿瘤效果。DNAM-1作为其中唯一的激活型受体,被证明是PD-1/PD-L1信号通路的主要抑制对象,极大地强调了DNAM-1和Nectin/Necl共受体家族在免疫检查点疗法中的重要性,是极具开发潜力的免疫检查点疗法靶点。PVRIG在Nectin/Necl共受体家族中发现最晚,它广泛表达于CD4+T细胞、CD8+ T细胞、γδT细胞、NKT和NK细胞中,通过与配体Nectin-2互作抑制免疫细胞活化。
在前期研究中,高福和王寒团队解析了DNAM-1与配体Necl-5互作的分子机制,为靶向DNAM-1的免疫检查点抑制剂研发提供基础(PNAS, 2019)。在此基础上,研究团队继续深入探索PVRIG的免疫识别机制,首次解析了PVRIG与配体Nectin-2复合物的2.0 Å高分辨率结构,确定了二者间的“双锁钥”结合模式。PVRIG与Nectin-2之间亲和力为纳摩尔级,这在免疫受体-配体互作中较为少见,亦远高于其他Nectin/Necl共受体家族分子与Nectin-2的识别能力。研究团队在PVRIG结构中发现一个具有独特构象的CC'环,并证明了该独特构象增大了PVRIG与配体Nectin-2的互作界面,是PVRIG高亲和力识别配体的分子基础。
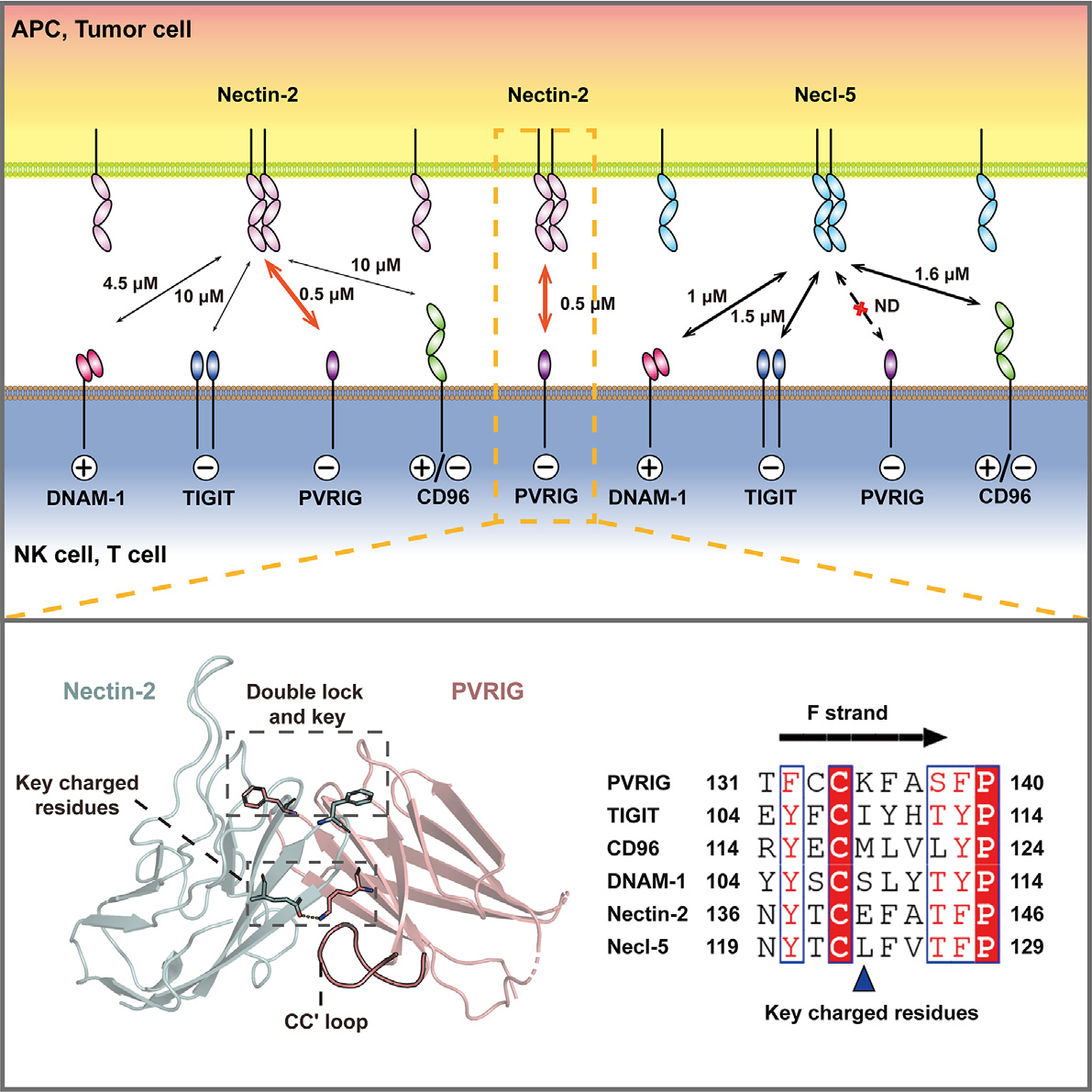
图1:Nectin/Necl共受体家族分子PVRIG的免疫识别和调节机制(图片摘要)
PVRIG在配体选择性上与其他Nectin/Necl共受体家族分子存在差异,其只能识别配体Nectin-2,而对另一共配体分子Necl-5无响应。为此,研究团队进一步研究并发现Nectin/Necl共受体家族分子与配体的互作界面中心存在一个关键位点,其上的氨基酸类型决定了Nectin/Necl共受体家族分子对配体的选择性。此外,研究团队还首次在同一水平上系统地比较了Nectin/Necl共受体家族分子与共配体之间的识别能力,并发现配体Nectin-2参与的免疫识别网络相对简单,其中抑制型受体PVRIG以绝对的亲和力优势竞争靶细胞配体并维持免疫稳态。相比之下,配体Necl-5介导的免疫识别网络表现出更为复杂的共受体间相互竞争和调控关系。
综上所述,这些发现拓展了对Nectin/Necl共受体家族分子介导的免疫识别和调节机制的理解,并为开发靶向Nectin/Necl共受体家族的免疫治疗策略提供理论依据。
安徽大学硕士生胡松涛(现博士就读于澳门大学)、王美玉(已毕业)、中科院微生物研究所博士后韩普、首都医科大学附属北京胸科医院曹晓庆博士为论文共同第一作者,威斯尼斯人615CC棋牌未来技术学院王寒副研究员为论文通讯作者。本研究受到威斯尼斯人615CC棋牌未来技术学院、中国科学院病原微生物与免疫学重点实验室、首都医科大学附属北京胸科医院和澳门大学等平台与单位支撑;同时得到国家重点研发项目、国家自然科学基金和威斯尼斯人615CC棋牌学科建设经费资助。
文章链接:https://www.cell.com/structure/fulltext/S0969-2126(24)00094-7
(免费下载链接:ttps://authors.elsevier.com/a/1iw-h3SNvcAbUp)
